ディレイカラムを用いたシステム由来のPFASによる妨害除去
- システム由来のPFASをトラップし、溶出を遅らせることで妨害を防ぎます
- サンプル中の微量レベルのPFASの定性および定量が正確におこなえます
- 保持が強く、平衡時間を延ばしてもその間の溶出はありません
ポリフルオロアルキル化合物およびパーフルオロアルキル化合物、すなわちPFASは、世界中で監視すべき最も重要な環境汚染物質として急速に浮上してきています。これらの化合物は幅広い分野での使用されており、環境での残留性もあることから、地球規模の問題となりえます。健康上のリスクに対する懸念から、環境科学者は南極のペンギン[1]から北極のホッキョクグマ[2]に至るまであらゆるところでこれらの化合物を探すことを余儀なくされ、文字通り端から端までPFAS汚染が広がっていることがわかってきています[3,4]。しかし、これらの化合物の一部が存在する場所については別の問題があります。すなわち、それが環境サンプル中のPFAS分析に使用される装置そのものの中にあることです。PFASコンタミネーションのもたらすバックグラウンドは、通常1兆分の1(ppt)以下となる微量レベルの定量を妨げる可能性があります。装置由来の汚染によるバックグラウンドは、フルオロポリマー(例:PTFE)を使ったLC部品から生じ、これは移動相溶媒中へと浸出する可能性があります。フッ素化合物を含まないチューブや容器の使用、装置の部品をPEEKやステンレスに変更することでバックグラウンド汚染のリスクはある程度低減できます。しかし微量分析への影響は排除しきれないため、他の解決策が必要です。
標準的な設定では、装置由来のPFASは移動相と一緒に流れており、グラジエント初期濃度の間にカラム先端に蓄積します。しかし、「ディレイカラム」と呼ばれるカラムを注入バルブの手前で移動相流路に追加すると、分離カラムに到達する前に装置由来のPFASを効果的に捕捉できます(図1)。このシナリオでは、サンプルが注入されると、サンプル内のPFASだけがカラムの先端にフォーカシングされます。その後、グラジエント分析が始まるとサンプル由来のPFASが分離カラムをいつも通りに移動していきます。平衡化の間にディレイカラムにトラップされていた装置由来のFPASも溶出し、分離カラムを通過していきます。ただし、装置由来のPFASは注入バルブの手前でディレイカラムに保持されるため、サンプル由来のPFASよりも遅れて溶出します。さらに、装置由来のPFASは注入毎に個別に導入されるわけではなく、流路内に常に存在するため、分離カラムの先端にフォーカシングされることはありません。ディレイカラムを使用することで、装置由来のバックグラウンドPFASとサンプル由来のターゲットPFASを区別することができるのです。
図 1: PFASディレイカラムの取付位置
図2は、正確なPFAS分析を妨げるバックグラウンド汚染の例です。ブランク注入の前に、装置由来のPFASを分離カラムの先端に蓄積させるためにシステムをディレイカラムなしで10分間平衡化しました。ここでは、装置ブランクとして5つの測定対象となりうる化合物が検出されました。どんな化合物がどの程度存在するかは結局のところ、それぞれの装置の状況によって異なります。装置由来のPFAS汚染は、装置の製造元、モデル、配管やフィッティングの材質、移動相溶媒のグレードや分析条件といった要因により変わる可能性があります。
図 2: ディレイカラムなしでブランクサンプルを分析するとシステム由来のPFASによる汚染が見られます。
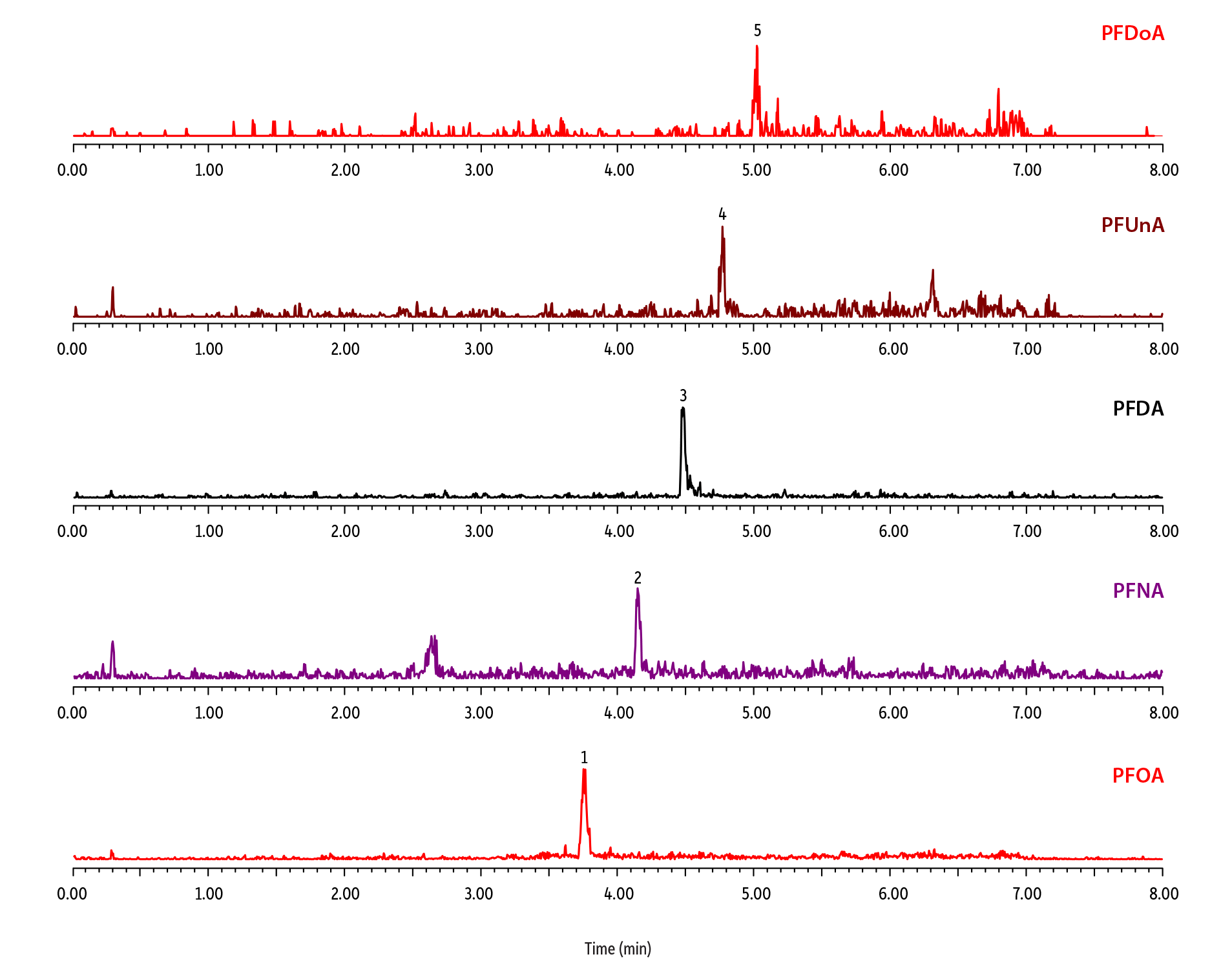
| Peaks | tR (min) | Precursor Ion | Product Ion | |
|---|---|---|---|---|
| 1. | Perfluorooctanoic acid (PFOA) | 3.75 | 413.2 | 369.1 |
| 2. | Perfluorononanoic acid (PFNA) | 4.15 | 463.2 | 419.2 |
| 3. | Perfluorodecanoic acid (PFDA) | 4.48 | 513.2 | 469.2 |
| 4. | Perfluoroundecanoic acid (PFUnA) | 4.77 | 563.2 | 519.2 |
| 5. | Perfluorododecanoic acid (PFDoA) | 5.02 | 613.2 | 569.2 |
| Column | Raptor C18 (cat.# 9304252) | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dimensions: | 50 mm x 2.1 mm ID | ||||||||||||||||||||||||
| Particle Size: | 1.8 µm | ||||||||||||||||||||||||
| Pore Size: | 90 Å | ||||||||||||||||||||||||
| Temp.: | 40 °C | ||||||||||||||||||||||||
| Standard/Sample | Blank injection without delay column after 10 minutes of equilibration. | ||||||||||||||||||||||||
| Diluent: | 80:20 Water:methanol | ||||||||||||||||||||||||
| Inj. Vol.: | 5 µL | ||||||||||||||||||||||||
| Mobile Phase | |||||||||||||||||||||||||
| A: | Water, 5mM ammonium acetate | ||||||||||||||||||||||||
| B: | Methanol | ||||||||||||||||||||||||
|
| Detector | MS/MS |
|---|---|
| Ion Mode: | ESI- |
| Mode: | MRM |
| Instrument | UHPLC |
流路へのディレイカラムの追加は、バックグラウンドのPFASを保持し、分析中にサンプル由来のPFASと共溶出しないようにする効果的な方法です。図2の実験をディレイカラムを取付て再度おこなうと、平衡時間を比較的長くしても先ほどのようなブランク注入でのPFASピークは見られませんでした。その代わり、装置由来のPFASバックグラウンドは目的の保持時間の後で広範囲にわたって溶出してきました。これはディレイカラムに保持された装置由来のPFASのバンド幅が平衡化の間に広がるためで、溶出時には明確なピークとしては現われません。このバックグラウンドPFASはベースラインがわずかに上昇した形で観察されます(図4)。
ディレイカラムが加えられたことで、ミキサーと注入バルブの間の流路が長くなり、グラジエント分析の移動相変化が分離カラムに到達するまでの時間が長くなるため、目的成分の保持時間もわずかにシフトします(図3)。PFASディレイカラムの実際の効果を図4に示します。目的成分の保持時間は装置由来のPFASとは異なるため、サンプル分析中に装置由来のPFASからの干渉を受けることはありません。平衡時間の長さと、遅れて出てくる装置由来のPFASが分離カラムから溶出して生じるベースラインの変動によって、図4に示している装置由来のPFAS溶出領域が決まることに注意してください。
図 3: ディレイカラムを取付けた場合のPFASの予想リテンションタイムは標準液を使用して設定しました。
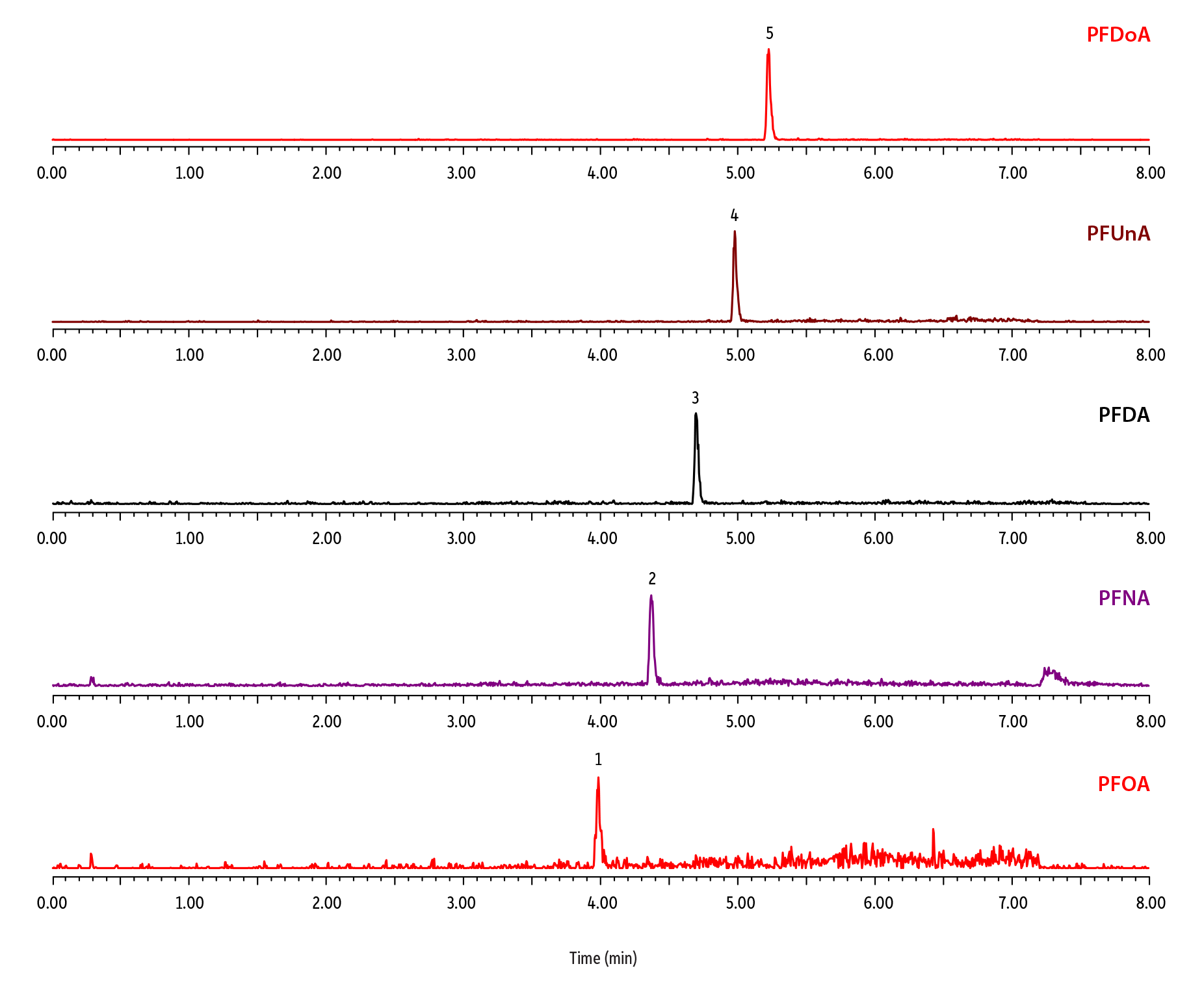
| Peaks | tR (min) | Conc. (ng/mL) | Precursor Ion | Product Ion | |
|---|---|---|---|---|---|
| 1. | Perfluorooctanoic acid (PFOA) | 3.99 | 0.1 | 413.2 | 369.1 |
| 2. | Perfluorononanoic acid (PFNA) | 4.37 | 0.1 | 463.2 | 419.2 |
| 3. | Perfluorodecanoic acid (PFDA) | 4.70 | 0.1 | 513.2 | 469.2 |
| 4. | Perfluoroundecanoic acid (PFUnA) | 4.98 | 0.1 | 563.2 | 519.2 |
| 5. | Perfluorododecanoic acid (PFDoA) | 5.23 | 0.1 | 613.2 | 569.2 |
| Column | Raptor C18 (cat.# 9304252) | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dimensions: | 50 mm x 2.1 mm ID | ||||||||||||||||||||||||
| Particle Size: | 1.8 µm | ||||||||||||||||||||||||
| Pore Size: | 90 Å | ||||||||||||||||||||||||
| Temp.: | 40 °C | ||||||||||||||||||||||||
| Standard/Sample | |||||||||||||||||||||||||
| Diluent: | 80:20 Water:methanol | ||||||||||||||||||||||||
| Conc.: | 0.1 ng/mL | ||||||||||||||||||||||||
| Inj. Vol.: | 5 µL | ||||||||||||||||||||||||
| Mobile Phase | |||||||||||||||||||||||||
| A: | Water, 5 mM ammonium acetate | ||||||||||||||||||||||||
| B: | Methanol | ||||||||||||||||||||||||
|
| Detector | MS/MS |
|---|---|
| Ion Mode: | ESI- |
| Mode: | MRM |
| Instrument | UHPLC |
| Notes | A PFAS delay column (cat.# 27854) was installed before the injector. |
図 4: ディレイカラムを使用すると、サンプル中のPFASが溶出するまで装置由来のPFASの溶出を遅らせられるため、その影響を排除できます。ブランクサンプルにPFASは検出されませんでした。矢印は予想保持時間を示します。
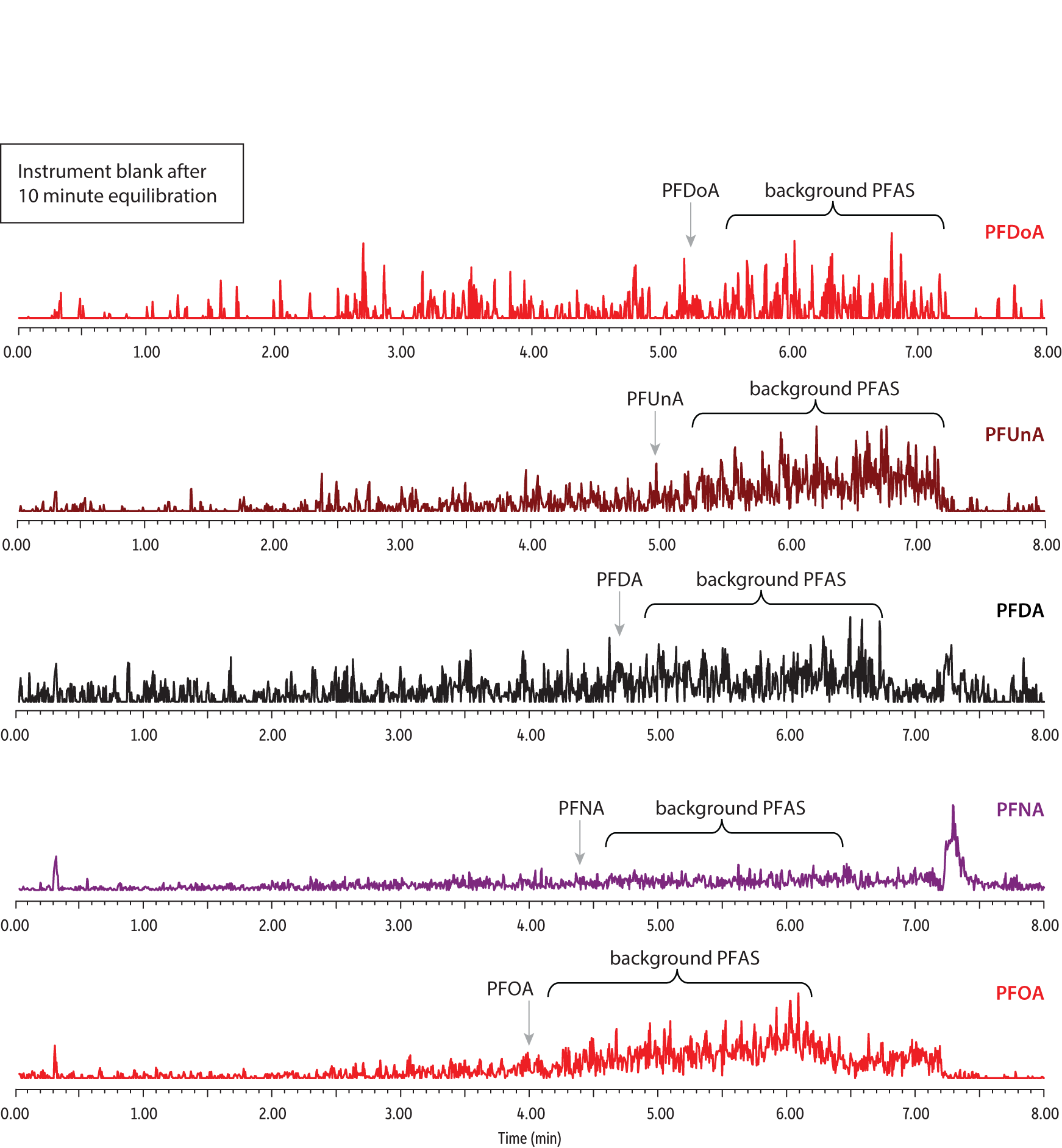
| Peaks | Precursor Ion | Product Ion | |
|---|---|---|---|
| 1. | Perfluorooctanoic acid (PFOA) | 413.2 | 369.1 |
| 2. | Perfluorononanoic acid (PFNA) | 463.2 | 419.2 |
| 3. | Perfluorodecanoic acid (PFDA) | 513.2 | 469.2 |
| 4. | Perfluoroundecanoic acid (PFUnA) | 563.2 | 519.2 |
| 5. | Perfluorododecanoic acid (PFDoA) | 613.2 | 569.2 |
| Column | Raptor C18 (cat.# 9304252) | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dimensions: | 50 mm x 2.1 mm ID | ||||||||||||||||||||||||
| Particle Size: | 1.8 µm | ||||||||||||||||||||||||
| Pore Size: | 90 Å | ||||||||||||||||||||||||
| Temp.: | 40 °C | ||||||||||||||||||||||||
| Standard/Sample | Blank injection with delay column (cat.# 27854) after 10 minutes of equilibration. | ||||||||||||||||||||||||
| Diluent: | 80:20 Water:methanol | ||||||||||||||||||||||||
| Inj. Vol.: | 5 µL | ||||||||||||||||||||||||
| Mobile Phase | |||||||||||||||||||||||||
| A: | Water, 5mM ammonium acetate | ||||||||||||||||||||||||
| B: | Methanol | ||||||||||||||||||||||||
|
| Detector | MS/MS |
|---|---|
| Ion Mode: | ESI- |
| Mode: | MRM |
| Instrument | UHPLC |
まとめると、PFASディレイカラムを使用することで、装置由来のPFASを分離カラムに入る前に保持し、サンプルが注入され、グラジエント溶出が始まった後にディレイカラムから溶出させることで、バックグラウンドPFASによるシステムブランクピークを排除できます。サンプル中の目的PFASとLCシステム由来のバックグラウンドPFASの間の溶出遅延は、サンプル中の目的成分の正確な定量を可能にするのに十分な分離をもたらします。
参考文献
-
A. Schiavone, S. Corsolini, K. Kannan, L. Tao, W. Trivelpiece, et. al. Perfluorinated contaminants in fur seal pups and penguin eggs from South Shetland, Antarctica, Sci. Total., 407 (12) (2009) 3899-904. https://doi.org/10.1016/j.scitotenv.2008.12.058
-
S. Tartu, S. Bourgeon, J. Aars, M. Andersen, et al. Diet and metabolic state are the main factors determining concentrations of perfluoroalkyl substances in female polar bears from Svalbard, Environ. Pollut., 229 (2017) 146-158. https://doi.org/10.1016/j.envpol.2017.04.100
-
K. Rankin, S. Mabury, T, Jenkins, J. Washington, A North American and global survey of perfluoroalkyl substances in surface soils: Distribution patterns and mode of occurrence, Chemosphere, 161 (2016) 333-41. https://doi.org/10.1016/j.chemosphere.2016.06.109
-
B. Gonzalez-Gaya, J. Dachs, J Roscales, G. Cabellero, B. Jiminez, Perfluoroalkylated Substances in the Global Tropical and Subtropical Surface Oceans, Environ. Sci. Technol., 48 (22) (2014) 13076-84. https://pubs.acs.org/doi/abs/10.1021/es503490z

